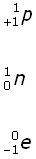Atome
Was ist ein Atom?
Zur Einführung wollen wir uns erst mal klar machen, was man unter einem Atom versteht. Als Beispiel nehmen wir mal ein
Blatt Papier. Zerreist man es in der Mitte, hat man - wie sollte es anders sein - zwei kleinere Stücke. Zerreist man
eines der Stücke, bekommt man wieder zwei noch kleinere und so weiter und sofort. Stellt sich nur die Frage: Wie oft
kann ich ein Stück Papier halbieren, bis es nicht mehr geht? Bis zu welchem Punkt kann ich kommen, und ab wann kann
ich nichts mehr teilen?
 Der Mensch an sich ist ja in solchen Sachen ziemlich unfähig. Daher hat er auch Maschinen erfunden, die einen Stoff weiter zerteilen können. Aber selbst die genaueste Maschine muss irgendwann aufgeben, da wir zum einen nicht weit genug entwickelt haben und zum anderen sicher sind, dass man einen Stoff nicht unendlich oft zerteilen kann.
Der Mensch an sich ist ja in solchen Sachen ziemlich unfähig. Daher hat er auch Maschinen erfunden, die einen Stoff weiter zerteilen können. Aber selbst die genaueste Maschine muss irgendwann aufgeben, da wir zum einen nicht weit genug entwickelt haben und zum anderen sicher sind, dass man einen Stoff nicht unendlich oft zerteilen kann.
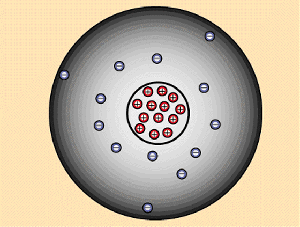
Es wird davon ausgegangen, dass es ein Minimum eines Stoffes gibt, dass sich nicht mehr teilen lässt. Dieses Minimum wird als Atom bezeichnet. Rechts von diesem Text ist so ein Atom, unglaublich stark vergrößert und nur im Modell. Es handelt sich um das Aluminium-Atom (im Periodensystem Al, Ordnungszahl: 13). Das runde in der Mitte ist der Atomkern. Er besteht aus positiv geladenen Protonen und ungeladenen Neutronen. Der Atomkern macht einen
Großteil des Gewichts vom Atom aus. Um den Atomkern kann man die negativ geladenen Elektronen sehen. Aluminium hat 13 Protonen und 13 Elektronen. Da gleich viele positive und negative Ladungen vorhanden sind, ist das gesamte Atom elektrisch neutral. Wären mehr Protonen vorhanden, wäre das Atom positiv geladen, wären mehr Elektronen vorhanden, wäre das Atom negativ geladen.
Im Periodensystem der Elemente (PSE) finden wir bei Aluminium folgende Informationen:

| Definition: Das Atom |
| kleinste, mit chemischen Mitteln nicht weiter zerlegbare Einheit eines chemischen Elements. Der besondere Aufbau jedes Atoms (Atombau) aus positiv geladenem Kern und negativ geladener, aus Elektronen bestehender Atomhülle* bedingt das physikalische und chemische Verhalten der Atome der einzelnen Elemente. (Aus: Schüler Duden Physik - Ein Sachlexikon für die Schule) |
Isotope
Stellt sich nur die Frage, wie solche "krummen" Zahlen dann zustande kommen. Im Al-Atom variiert die Anzahl der Neutronen. Mal ist sie mehr, mal ist sie weniger. Für die Masse wurde dann einfach nur ein Mittelwert genommen, d.h., es ist möglich, dass ein Al-Atom 13 anstatt 14 Neutronen besitzt. Das ist aber relativ selten der Fall. Daher ist die Masse näher an der 27 als an der 26. Atome, die eine solche "unentschlossene" Masse haben, werden Isotope genannt.
| Atommodell nach Ernest Rutherford (1911) |
| Ein Atomkern besteht aus positiv geladenen Protonen p und elektrisch neutralen Neutronen n. In der Atomhülle bewegen sich negativ geladene Elektronen e auf Kreisbahnen um den Atomkern mit verschiedenen Bahnradien. |
Daten und Fakten
Nun ist es sicherlich interessant zu wissen, was denn so ein Atom wiegt. Wie gesagt, so ein Atom ist verdammt klein, also wohl auch ziemlich leicht. Dennoch weiß man, was wie viel wiegt. Auch andere Daten von Atomteilen sind bekannt. Hier eine kurze Übersicht:
| Bestandteil | Masse/kg | Durchmesser/m | Ladung/C |
| Elektronen e | 9,10938*10-31 | <10-17 | -1,6022*10-19 |
| Protonen p | 1,67262*10-27 | 10-15 | +1,6022*10-19 |
| Neutronen n | 1,67493*10-27 | 10-15 | 0 |
| Atomkern | - | ca. 10-15 | - |
| Atomhülle | - | ca. 10-10 | - |
0,000000000000001 Meter (Kern)
0,0000000001 Meter (Hülle)
Definitionen
Protonen und Neutronen heißen Nukleonen. Weil aus ihnen Atomkerne gebildet sind, werden diese Nuklide genannt.
Atome mit gleicher Kernladungszahl aber variierender Neutronenzahl heißen Isotope.
| Für jeden Nuklid gilt: | ||||||||||||||||||
|
Schreibweisen und Beispiele
Schreibweise: ![]()
Beispiel: ![]()
(Spaltbares Uran mit 235-92=143 Neutronen.)
Auch Protonen, Neutronen und Elektronen werden so dargestellt: